Mercurius Philosophorum
Der Mercurius Philosophorum ist die Vorstufe zum sagenhaften Stein der Weisen und wird mit dem Azoth C12T12O aus dem Gold gezogen.
In der „Pharmacopoeia universalis“ des Frankfurter Arztes Johann Schröder (*1600 – †1641), treuer Anhänger des Alchemisten Paracelsus, heißt es, Zitat: „Der Mercurius ist nichts anderes als ein mineralischer und metallischer flüchtiger Liquor, von den Alchemisten auch unser lebendig machendes Wasser genannt, der vor allen anderen Metallen sich gern zum Golde gesellet und sich an selbiges hängt“. Der Mercurius Philosophorum kann nicht hergestellt werden ohne den Azoth, das auflösende Wasser der Alchemisten. Der Alchemist Zosimos aus Panopolis (auch genannt Rosinus) nennt das auflösende Wasser göttlich, Zitat: „Ohne das göttliche Wasser kann nichts geschehen, mit diesem wird das Werk unternommen“. Die kürzeste Formel zur Darstellung des Mercurius Philosophorum lautet: “Fac Mercurium per mercurium adaquam mercurialem”: Mach den Merkur durch den Merkur zu einem merkurialen Wasser, das heißt bringe die Körper durch Wasser ins Wasser zur ersten Materie wieder zurück. Die Alchemisten sagten: „In mercurio est, quidquid quaerunt sapientes“, was übersetzt heißt: Im Merkur findet sich alles, was die Weisen suchen. Die Erweckung des in den Metallen, vorzüglich aber des im Golde schlummernden universellen odischen Feuerkeimes, (Sulphur) ist die Aufgabe des Alchemisten. Doch nur das Azoth vermag das Gold radikal aufzulösen und in seine Materia Prima zurückzuführen. Die Solution des Goldes wird von den Alchemisten auch der Hauptschlüssel des großen Werkes genannt. Das Gold wird durch das auflösende Wasser (Azoth) in seine prima Materia, seine Quintessenz zurückverwandelt, es kommt zur Scheidung und der Mercurius Philosophorum entweicht. Fange diesen Mercurius Philosophorum und verwahre in gut, denn dies ist die eigentliche Materia prima des Steins der Weisen (Lapis Philosophorum). Um den Mercurius Philosophorum aus dem Gold zu ziehen, muss das Gold vorher alchemistisch aufbereitet werden. Dazu muss der Sulphur des Goldes (IGNIS) aktiviert werden. Das Gold wird zunächst alchemistisch kalziniert und zu einem Metallkalk (Pulver) reduziert. In der Sprache der Alchemie bedeutet Kalzination weiß machen wie Kalk. Der Schweizer Pharmakologe Christophe Glaser (* um 1615 † um 1678) verstand unter Kalzinieren das zu Kalk oder Pulver machen durch ein unsichtbares Feuer oder sichtbares Feuer; das sichtbare ist das ordinäre Feuer. Das unsichtbare ist das innere Feuer in den Scheidewassern und zerfressenden Geistern. Aufgrund des edlen Charakters des Goldes ist eine direkte Calzination im Feuer aber nicht möglich. Die alchemistische Calzination geschieht durch Calzination auf nassem Wege; zuerst wird das Gold aufgelöst und bildet mit dem flüssigen Lösungsmittel eine Einheit; der Metallkörper wird flüssig gemacht, wie die Alchemisten sagen. Fügt man nun ein Präzipitationsmittel zu der Lösung hinzu, so erscheint das Gold wieder als fester, nun aber pulverisierter Stoff. Die gebräuchlichste Calzination des Goldes auf nassem Wege geschah mit Aqua regia. Diese auch Königswasser genannte Flüssigkeit war ein Gemisch aus einem Teil Salpetersäure und drei Teilen Salzsäure: 3HCl + HNO3 ➔ H2O + Cl2 + 2 NO2.
Bei der Auflösung von elementarem Gold in Königswasser ensteht Tetrachlorogoldsäure: 10 Au + 3 NH4NO3 + 40 HCl = 10 HAuCl4 + 9 H2O + 6 NH4 . (Nitrosylchlorid – das aktive Reagens in Königswasser – muss durch Abrauchen mit Salzsäure entfernt werden, wobei Nitrose Gase bzw. Stickstoffdioxid entweichen).
Das Königswasser, dessen sich die Adepten in der hohen Alchemie bedienten, entstand aber aus Salpetersäure (HNO₃) und Ammoniumchlorid (NH4Cl) nach folgender Reaktion: HNO3 + NH4Cl ➔ HCl + NH4NO3. Das Königswasser der Alchemisten enthält ammoniakalischen Salpeter. Ammoniumchlorid gewannen die Alchemisten aus dem Ammoniakwasser der Steinkohle durch Neutralisation mit Salzsäure. Salpetersäure ist schon seit dem 8. Jahrhundert bekannt. Der arabische Alchemist Geber gewann rohe Salpetersäure (spiritus nitri) durch trockenes Erhitzen von Salpeter mit Kupfervitriol und Kalialaun, so beschrieben in der alchemistischen Schrift „Liber De inventione veritati“ (12. Jhd.). Der Alchemist Johann Rudolf Glauber gewann Mitte des 17. Jahrhunderts reinen spiritus nitri durch Umsetzung und Destillation von Salpeter mit Schwefelsäure. Auch Schwefelsäure war schon lange bekannt. Die erste Destillation von Schwefelsäure (alter Name Vitriolöl) wird dem burgundischen Dominikanermönch Vincenz de Beauvais (*1190 – †1254) zugeschrieben. Salzsäure ist auch schon lange bekannt, wird aber in der alchemistischen Literatur erstmalig in der ersten Hälfte des 15. Jahrhunderts erwähnt. Der Alchemist Andreas Libavius gewann Salzsäure durch Glühen einer Mischung von Kochsalz, Ton und Einleitung der sich bildenden Dämpfe in Wasser. Der Alchemist Basilius Valentinus gewann Salzsäure durch Reaktion von Halit (Steinsalz) mit Eisenvitriol. Die Herstellung der Salzsäure aus Speisesalz und Schwefelsäure gelang J. R. Glauber im 17. Jahrhundert. Bei der Auflösung von Gold im Aqua regia der Alchemisten entsteht eine geheimnisvolle Gold-Stickstoff-Verbindung, das sog. Knallgold (Aurum fulminans oder Aurum toniturans). Bisher konnte die Verbindung noch nicht eindeutig mit einer chemischen Formel beschrieben werden. Die Zusammensetzung wurde versuchsweise mit der Formel Au(OH)s – 3 NH3 (Amminohydroxid) oder als Goldhydrazid beschrieben. Auch über die Zusammensetzung Au2O3 (4NH3) oder Au2O3 (4NH4) wurde berichtet.
2 Au + 10 HCl + NH4NO3 = 2 Au(OH3)NH3 + 10 Cl + H2O
2 Au(OH3)NH3 + 2 O2 = Au2O3*2NH3 + 3 H2O
4 Au(OH3)NH3 + 3 O2 = 2 Au2O3*2NH4 + 4 H2O
Knallgold entsteht durch die Reaktion von Gold(III)-oxid, Goldhydroxid oder Gold(III)-chlorid mit wässriger Ammoniaklösung oder Ammoniumsalzen. Die Verbindung weist eindeutig eine direkte Gold-Stickstoff-Bindung auf. Spätere Analysen zeigten, dass man nur den Grundbaustein des Netzes kennt: ein Goldatom, das an vier Stickstoffatome gebunden ist. Außerdem kommen Wasserstoff, Sauerstoff und Chlor vor. Eine andere Reaktion wäre.

Das erhaltene einheitliche Amminohydroxid geht beim Trocknen in das Triamminogold(III)-oxid: Au2O3 (4NH3) über. Dies ist das Goldoxid-Ammoniak, ein grünliches Pulver, das als Knallgold bekannt ist. Knallgold wurde als dreckig oliv-grünes Pulver beschrieben, wenn es aus Goldhydroxid und Ammoniakwasser hergestellt wurde, oder als gelbes bis schwarzes Pulver bei der Herstellung aus Goldoxid und konzentrierten Ammoniak. Knallgold ist in den meisten Lösungsmitteln nur schlecht löslich, in wässrigen Gold(III)-, Ammoniak- und Chloridsystemen hingegen ist es gut löslich.
Valentinus schrieb über das Knallgold, Zitat: „Trockne den Goldkalk in der Luft, da keine Sonne hineinscheint, und ja nicht über dem Feuer, denn sobald dieses Pulver eine sehr geringe Hitze oder Wärme empfindet, zündet sich solches an, und thut merklichen grossen Schaden, denn so würde es flüchtig davongehen, mit grossem Gewalt und Macht, dass ihm kein Mensch würde steuern können.“
Knallgold ist äußerst schlag- und wärmeempfindlich und explodiert schon bei geringer Hitze in verschlossenen Gefäßen eben so, als an der freien Luft und sollte daher nur im feuchten Zustand aufbewahrt werden. Im feuchten Zustand lässt sich Knallgold auch ohne Verpuffung weiterverarbeiten. Bei seiner Verbrennung entsteht ein purpurroter Rauch. Die explosive Eigenschaft von Knallgold musste auch der bekannte Chemiker Jöns Jakob Berzelius erfahren, als er im Jahr 1809 unvorsichtig damit hantierte. Die Explosion war so stark, dass er beinahe erblindete. In seinem Handbuch der angewandten Chemie von 1844 beschreibt der französische Wissenschaftler (Angehöriger der königlichen französischen Akademie der Wissenschaften) Jean-Baptiste Andre‘ Dumas die explosive Eigenschaft von Knallgold ein wenig harmloser. Zitat: Feuchtes Knallgold verpufft beim Erhitzen erst, wenn es trocken geworden ist und dann auch nicht heftig, sondern in einzelnen Anteilen, im Verhältnis als diese ihr Wasser verlieren. Die vollständige Verpuffung durch Erwärmen erfolgt bei 143 °C. Knallgold wird zum ersten Mal 1585 erwähnt – in einer Schrift des deutschen Alchemisten Sebald Schwertzer (*1552 – †1598) „Über die Herstellung des Steins der Weisen“. Schwertzer wirkte als Hofalchemist am Hof des Kurfürsten August von Sachsen. Durch sein Können soll angeblich das reiche Goldvermögen im Nachlass des Kurfürsten und seines Nachfolgers Kurfürst Christian I. entstanden sein. Auch der französische Chemiker Jean Beguin (* um 1550 † um 1620) erwähnt Knallgold (Or fulminat diaphoretic) in seinem Werk „Les elemens de chymie (1615)“. In der 1577 von einem unbekannten Alchemisten kompilierten Schrift „Wegweiser/Viatorium“ findet man eine in Versen gehaltene Rezeptur der Knallgoldherstellung unter dem Titel „Von der Essenz des Goldes“. Knallgold war den Alchemisten also auf jeden Fall bekannt. Die Substanz hat eindeutig einen alchemistischen Ursprung. Neben Basilius Valentinus behauptet auch der Alchemist Johann Kunckel nach gleichem Verfahren ebenfalls Knallgold hergestellt zu haben. Wird Knallgold kontrolliert zur Explosion gebracht, entsteht reiner Goldkalk. Das ist nach Ansicht einiger Alchemisten die ursprüngliche jungfräuliche Erde, der Pelikan, aus dessen Brust der Sulphur strömt. Ein anderer Weg klingt vielversprechender. Einige Alchemisten amalgamieren metallisches Gold mit Quecksilber, das entstandene 1Goldamalgam amalgamieren sie nochmals. Diesmal aber mit Schwefel und erhalten nach Abdestillieren des entstandenen Quecksilbersulfids monoatomisches Gold. Das ist das Calx des Goldes, ein weißes Pulver mit ganz anderen physikalischen Eigenschaften als das metallische Gold.
Gleichungen:
2Au + 4Hg → Au2Hg3(Goldamalgam) + Hg
Au2Hg3 + 3S + Δ (O2)→ 2AuO(monoatomisches Gold) + 3HgS(Zinnober)
Es gibt offensichtlich eine völlig neue unbekannte Phase der Materie, die aus monoatomaren Elementen besteht. Sie ist so lange unbekannt geblieben, weil sie inert und mit normalen Analysemethoden nicht nachweisbar sind. Um ein monoatomisches Element nachzuweisen, muss man es zuerst von seinem monoatomischen Zustand in seinen normalen Zustand umwandeln, damit das Element mit konventionellen Instrumenten nachgewiesen werden kann. Das erzeugte monoatomische Gold z. B. ist in den meisten heute üblichen Analyseverfahren nicht mehr als Gold nachweisbar. Einzig in der ICP-Analyse, wo es via Plasma zurückverwandelt („revivifiziert“) wird, ist es als Gold wieder feststellbar.
Der Goldkalk muss mit dem auflösenden Wasser der Alchemisten (Azoth) imbibiert und digeriert werden, um anschließend wiederholt destilliert werden zu können. Indem das AZOTH bei jeder Destillation etwas vom Goldkalk mit sich in die Höhe nimmt, wird er immer feuriger, bis er zuletzt den Goldkalk radikal auflösen kann.
56AuO + C12T12O → 6AuT2 + 4C3Au2O9 + 21Au2O
Die Destillation ist so lange zu wiederholen bis kein Rückstand mehr in der Retorte bleibt, das heißt, dass man das Destillat auf den Rückstand zurück zu gießen und von Neuem zu destillieren hat (Mehrfachdestillation). Dieses Verfahren wurde von den Alchemisten Kohobation genannt. Sie kann mit gleichem Ergebnis auch in Form der Rückflussdestillation (Zirkulation) durchgeführt werden. Der Destillierkolben wird mit einem Rückflusskühler versehen, durch den ein Teil der abgedampften Flüssigkeit wieder kondensiert und in den Kolben zurückfließt. Das Tritium diffundiert dabei im Gold. Ammoniak und Kohlenmonoxid verflüchtigen sich im Laufe des Prozesses. Alle Wasserstoffisotope besitzen die Eigenschaft, sich in Festkörpern in atomarer oder molekularer Form zu lösen und in ihnen zu diffundieren (2Diffusion). Deuterium und vor allem Tritium in weit höherem Maß als Protium. Moleküle, die Tritium enthalten (T2, DT, HT) sind durch die beta-Strahlung und durch die Wirkung des sehr reaktiven 3HeT+-ions (Zerfallprodukt von T2) chemisch besonders reaktiv. Um eine Explosion zu vermeiden, muss die Imbibierung und Destillation des Goldkalks vorsichtig geschehen. Die entstehenden Gase müssen durch eine Kühlvorrichtung (Kühlrohr) zum Auffangbehälter geleitet werden. Das resultierende Wasser nannte der Alchemist Fulcanelli “Philosophical Mercury” (Mercurium philosophorum). Die Forderung der Alchimisten lautete: Tue nichts Entscheidendes, bevor nicht alles zu Wasser geworden ist. Dieser Vorgang war ein Teil des großen Werkes: „die Flüchtigmachung der Salze“. Durch die wiederholte Kohobation oder Zirkulation erhielt man ein klares Wasser (oleu), das äußerst flüchtig ist und eine tiefrote Tinktur, deren Farbe sich vertiefte, je länger sie aufbewahrt wurde. Diese Substanzen sind der gereinigte Mercurius, der Sulphur und das Sal, die drei Grundsubstanzen für den Lapis Philosophorum. Philosophischer Mercurius (AuT2) erscheint als ein klares Wasser mit metallischen Reflexen. Philosophischer Sulphur (C3Au2O9) erscheint als rotes Öl, ist bei Transparenz purpurrot und hat die metallischen Reflexe des Scarabäus. Philosophisches Sal (Au2O) tritt in kleinen silberhellen, stark lichtbrechenden Kristallen auf. Beim Sulphur der Alchemisten könnte es sich um ein 3Metallocen oder ein 4Metallcarbonyl handeln. Letztere sind Komplexverbindungen mit Metallen und Kohlenmonoxid CO als Ligand. Die Methylgruppe –CH3, besteht also aus einem Kohlenstoff- und drei Wasserstoff-Atomen. Sie ist keine eigenständige chemische Substanz, sondern stets Teil eines größeren Moleküls. Die Methylengruppe ist eine funktionelle Gruppe mit der formalen Einheit CH2. Die einfachste chemische Verbindung mit einer Methylengruppe ist Methylen (CH2), ein sehr reaktives Carben. Beim Metallcarbonyl ist das Wasserstoffatom direkt an das Metall gebunden. Die Verbindungen sind aber sehr instabil. Durch die Verwendung von starken Säuren gelang auch die Darstellung eines stabilen Goldcarbonylkations wie [Au(CO)2]+. Wissenschaftlern der Universität Heidelberg ist es gelungen, eine Kohlenstoff-Gold-Verbindung, das heißt einen stabilen Goldcarbenkomplex zu isolieren. Damit hat das Team um den Chemiker Prof. Dr. Bernd F. Straub die Grundlage dafür geschaffen, die ansonsten instabile Doppelbindung zwischen Kohlenstoff und Gold erstmals direkt untersuchen zu können. Vielleicht nutzten die Alchemisten aber auch bereits die 5Nanotechnologie für ihre Zwecke. Vielleicht ist das große Werk angewandte Nanotechnologie. Effekte, wie sie viele Nanotechnologien nutzen, kommen häufig in der Natur vor. Insbesondere die Selbstreinigungsfähigkeit hydrophober (=wasserabweisender) Oberflächen wie bei der Lotuspflanze (Lotuseffekt).
Ausgangspunkt für den Stein der Weisen ist das legendäre Goldöl. Das Azoth ist absolut wesentlich für die Herstellung des Goldöls. Es wird dem Goldkalk hinzugefügt. Die Endprodukte sind Mercurium philosophorum und Sal Philosophorum. Dabei löst sich das Gold nicht auf dem üblichen chemischen Wege, wie die vorherige Auflösung in Königswasser*, sondern das Gold entmischt (zersetzt) sich auf atomarer Ebene durch die ätherische Energie der Lösung. Das Goldöl ist nicht zu verwechseln mit dem Aurum Potabile (trinkbares Gold). Dabei handelt es sich um rote Dispersionen von kolloidalem Gold in Wasser, die im Mittelalter Anwendung gegen zahlreiche Krankheiten fanden. Goldkolloide (Goldnanopartikel) sind seit der Antike bekannt und wurden zur Glasfärbung benutzt. Bekannt waren zwei Arten von kolloidalem Gold, nämlich das Aurum potabile (trinkbares Gold, bzw. Lösungen, in welchen Gold enthalten war) und Goldpurpur (Purpur von Andreas Cassius zur Herstellung von Rubinglas). Michael Faraday (*1791 – †1867) ein englischer Naturforscher und anerkannter Chemiker seiner Zeit, führte bereits 1857 entsprechende Experimente mit Goldnanopartikeln (Goldkolloide) durch. Seine damals hergestellten Goldnanopartikel-Dispersionen sind noch heute stabil und im London Museum zu besichtigen. 1825 entdeckte Faraday in den Rückständen von Leuchtgas eine flüssige Substanz, die er als „Bicarburet of Hydrogen“ bezeichnete, und die sich später als Benzol herausstellte. Erst mit der Gewinnung des Mercurius Philosophorum, des Schlüssels der Metalle, findet die umfangreiche, sich nicht selten über ein ganzes Jahr erstreckende und mit großen Schwierigkeiten verbundene Vorarbeit ihr gewünschtes Ende.

1Goldamalgam
Es ist unmöglich, Quecksilber und Gold durch Zusammenschmelzen zu vermischen, da das Quecksilber bei relativ niedriger Temperatur verdampft. Stattdessen werden die beiden Metalle in einen Mörser und Stößel gegeben und gemeinsam zermahlen. Der Prozess wird ein wenig unterstützt, wenn man Gold und Quecksilber zunächst in einem geschlossenen Behälter zusammenbringt und ineinander diffundieren lässt. Um die Gefahr einer Belastung durch giftige Quecksilberdämpfe zu verringern, erfolgen die Arbeiten unter einem Abzug. Quecksilber entwickelt bereits bei Raumtemperatur giftige, unsichtbare Dämpfe. Wenn Quecksilber erhitzt wird, werden die Dämpfe noch aggressiver freigesetzt. Diese Dämpfe werden über die Lunge aufgenommen und im Körper gespeichert; sie können nicht abgestoßen werden und sammeln sich daher an. Dies bedeutet, dass selbst eine geringe Exposition letztendlich zu einem Gesundheitsrisiko führt. Die ersten Anzeichen einer Quecksilbervergiftung sind Zahnfleisch- und Rachenentzündungen, nervöse Störungen, Reizbarkeit, allgemeine Schmerzen, Muskelzittern und Ohnmacht. Der Prozess der Goldamalgamherstellung gehört zu den Prozessen, die von Theophilus, Plinius und anderen frühen Autoren der Metallbearbeitung gut dokumentiert wurden. Die in diesen antiken Quellen angegebenen und auch heute noch relevanten Verhältnisse betragen 1 Teil Gold zu 8 Teilen Quecksilber oder 11,1 % Au/88,9 % Hg. Bei Raumtemperatur besteht die Mischung aus einer intermetallischen Phase Au2Hg3 (eine Konzentration von etwa 39 % Au; 61 % Hg aus etwa 37 % festem Au2Hg3 und 63 % flüssigem Quecksilber. Man könnte sagen, dass das Gold im Quecksilber „schwimmt“, so wie zerstoßenes Eis im Wasser schwimmt. Es entsteht eine hellgelbe, teigartige Masse = Goldamalgam.
2Diffusion
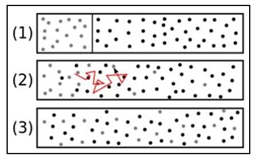
Interdiffusion ist die Diffusion (Verschmelzung, gegenseitige Durchdringung) zweier verschiedener Atomsorten aus ehemals getrennten Bereichen ineinander. Bei molekulardispersen Systemen handelt es sich um klare und durchsichtige Lösungen, bei denen keine Phasengrenze erkennbar ist. Sie zeichnen sich dadurch aus, dass sie physikalisch stabil und homogen sind, d.h., dass sich die gelösten Ionen und Moleküle nicht durch Filtrieren oder Zentrifugieren vom Lösungsmittel abtrennen lassen (echte Lösung). Bei den Suspensionen handelt es sich um heterogene Gemenge. Sie gehören also nicht zu den Lösungen, wohl aber zu den dispersen Systemen. Im weitesten Sinne werden alle homogenen Gemenge als Lösungen bezeichnet Im engeren Sinne versteht man unter Lösungen nur die homogenen Gemenge, bei denen das Dispersionsmittel (Lösungsmittel) flüssig ist. Als disperse Phase können dabei Stoffe vorliegen, die (unvermischt) bei Zimmertemperatur gasförmig, flüssig oder fest sind. Diffusion ist der ohne äußere Einwirkung eintretende Ausgleich von Konzentrationsunterschieden in Flüssigkeiten oder Gasen als natürlich ablaufender physikalischer Prozess aufgrund der brownschen Molekularbewegung. Im Kontext des Opus magnum steht der Begriff Diffusion für die Permeatation eines Gases durch einen Feststoff. Bei diesem Vorgang durchdringt oder durchwandert das Gas (Permeat) einen Festkörper. Das führt mit der Zeit zu einer vollständigen Durchmischung der Gasteilchen im Feststoff durch die gleichmäßige Verteilung der beweglichen Teilchen und erhöht damit die Entropie des Systems. Bei den Gasteilchen kann es sich um Atome (Atomgas), Moleküle oder Ladungsträger (Elektronengas, Ionengas, Plasma) handeln. Einer der beteiligten Stoffe ist meistens ein Gas oder eine Flüssigkeit, doch auch Feststoffe und Plasmen diffundieren ineinander. Die Triebkraft (Druckdifferenz) ist dabei ein Gradient des chemischen Potenziales des Permeates. In den meisten Fällen kommt es nach einiger Zeit wieder zur Desorption: Das Adsorbat entweicht als Gas auf der anderen Seite des Feststoffes. Die Diffusion bei einer bestimmten konstanten Temperatur erfolgt ohne weitere Energiezufuhr und ist in diesem Sinne passiv; vor allem in der Biologie wird die Diffusion vom aktiven Transport unterschieden. Unter einem aktiven Transport versteht man einen unter Energieverbrauch ablaufenden Transport gegen einen Konzentrationsgradienten (Konzentrationsgefälle zwischen zwei mischbaren Stoffen unterschiedlicher Konzentration) oder elektrischen Gradienten (unterschiedliche Konzentrationen geladener Teilchen, Ionen). Das Eduard-Zintl-Institut der Technischen Hochschule Darmstadt hat neben seinen Arbeiten über die Diffusion von Wasserstoff (Protium) in Kupfer und in Silber auch das Verhalten von Wasserstoff in Gold untersucht. Die in früheren Veröffentlichungen von anderen Autoren vertretene Ansicht, dass Wasserstoff in Gold unlöslich sei, konnte nicht bestätigt werden. Vielmehr ergab sich, dass nach den vom Institut durchgeführten Messungen ein Grammatom Gold bei 700 °C rund 4 – 1 0 ‚ 6 , und bei 900 °C ca. 8-10″6 Mol Wasserstoff bei einem Beladungsdruck von 1 Atmosphäre aufnimmt. Die Wasserstofflöslichkeit liegt damit deutlich unterhalb derjenigen von Kupfer und von Silber. Die unterschiedlichen Werte der Aktivierungsenergie in Silber und Gold, deren Gitterkonstanten praktisch gleich sind, lassen erkennen, dass nicht allein Struktur und Gitterkonstante die Diffusionsgeschwindigkeit bestimmen. Die Differenz der Aktivierungsenergie ist nach Auffassung der Wissenschaftler auf Unterschiede im Zustand des diffundierenden Wasserstoffs zurückzuführen. Daraus könnte man schließen, dass aktivere Wasserstoffisotope wie D2 und T2 schneller und effektiver diffundieren als Protium. Eine ähnliche Untersuchung an dem System Gold-Sauerstoff scheiterte an der Eigenschaft des Goldes, keinen oder nur eine geringe Menge — nach den Messungen weniger als 10~7 mol/g Atom — Sauerstoff aufzulösen.
3Metallocene
Metallocenesind organometallische Bindungen, in denen ein zentrales Metallatom zwischen zwei Cyclopentadienyl-Liganden (C5H5, Abkürzung: Cp) angeordnet sind. Cyclopentadienylmetall-Verbindungen werden durch die Umsetzung eines Metalls mit Cyclopentadien hergestellt. Cyclopentadien C5H6 ist eine farblose, übel riechende Flüssigkeit. Man findet sie im Steinkohlenteer. Es ist die Vorläufersubstanz des Cyclopentadienyl-Anions, das als Ligand (Cp) in Metallocenen in der metallorganischen Chemie weitverbreitet ist. Das bekannteste Beispiel ist der Eisenkomplex Ferrocen. Bei reaktiven Metallen, wie die Alkalimetalle und Erdalkalimetalle können die Cycopentadienylmetall-Verbindungen direkt hergestellt werden. Bei den Elementen der Gruppe 4 bis 12 gelingt die nur bei dem besonders stabilen Ferrocen

1951 versuchten der US-amerikanische Chemiker Tom J. Kealy und der deutsch-britische Chemiker Peter L. Pauson an der Duquesne University die Darstellung von Fulvalen durch die Reaktion von Eisen(III)-chlorid mit Cyclopentadienylmagnesiumbromid entsprechend der nebenstehenden Gleichung durchzuführen. Statt des erwarteten Fulvalens erhielten Kealy und Pauson als Hauptprodukt orangefarbene Kristalle, die überraschenderweise an der Luft und bei Temperaturen über 300 °C stabil waren und leicht sublimiert werden konnten. Sie hatten das Ferrocen entdeckt. Metallocene gibt es von zahlreichen Metallen, z. B. Chromocen: CrCp2, Manganocen: MnCp2, Mercurocen: HgCp2, Nickelocen: NiCp2 und Zinkocen: ZnCp2. Metallocene von Kupfer, Silber und Gold konnten noch nicht hergestellt werden; Cu(C5H5)2 und Au(C5H5)2 wurden bisher nur berechnet.
4Metallcarbonyle
Als Metallcarbonyle Mn(CO)m werden Komplexverbindungen mit Metallen M als Zentralatom und Kohlenmonoxid CO als Liganden bezeichnet. Die Liganden (Teilchen oder Molekül, welche mindestens ein freies Elektronenpaar (Elektronenpaar-Donator) zur Bindungsbildung zur Verfügung stellen können) umschließen dabei das Zentralatom. Sie treten in Form neutraler Komplexe, als positiv geladene Metallcarbonyl-Kationen oder als negativ geladene Metallcarbonylat-Anionen auf. Zu den anionischen (mit negativer Ladung) Liganden zählen z. B. O2- (oxido); O22- (peroxido); OH– (hydroxido); H– (hydrido) . CO (carbonyl), NH3 (ammin), H2O (aqua) und NO (nitrosyl) hingegen sind neutrale Liganden. Komplexbildungsreaktion sind entweder Säure-Base-Reaktionen nach Brønstedi oder klassische Lewis-Säure-Base-Reaktionen nach der Theorie von Gilbert Newton Lewis (* 1875 – † 1946). Hierbei stellt das Zentralatom die Lewis-Säure (Elektronenpaar-Akzeptor) dar; die Lewis-Base ist der Ligand. Gold-Metallcarbonyle sind wegen der hochreaktiven Doppelbindung zwischen Kohlenstoff und Gold üblicherweise instabil. Wissenschaftlern der Universität Heidelberg ist es erstmalig gelungen, einen stabilen Goldcarbenkomplex zu isolieren. Fast alle Goldkomplexe sind farblos, der, stabile‘ Goldcarbenkomplex (Aggregatzustand: flüssig) dagegen weist eine intensive smaragdgrüne Farbe auf. Wird das Goldfragment protoniert, das heißt durch ein echtes Proton – den Kern des leichtesten Elements Wasserstoff – ersetzt, zeigt dieses anlog produzierte Carben eine purpurrote Farbe. Als Protonierung bezeichnet man in der Chemie die Anlagerung von Protonen (Wasserstoff-Kernen/ -Kationen) an eine chemische Verbindung im Rahmen einer Säure-Base-Reaktion. Die Protonierung gelingt durch die Verwendung von starken Säuren. Komplexbildungsreaktionen sind oft durch Farbumschläge gekennzeichnet. Bei der Komplexbildung treten sehr viele Eigenschaftsänderungen auf, die Eigenschaften des Komplexes unterscheiden sich oft deutlich von denen des Zentralions und der Liganden. Komplexverbindungen spielen in der Biologie oft eine entscheidende Rolle, so enthalten die für das Leben außerordentlich wichtigen Verbindungen Hämoglobin und Chlorophyll Metallkomplexe. Carbenkomplexe sind meist Übergangsmetallkomplexe (chemische Elemente mit den Ordnungszahlen von 21 bis 30, 39 bis 48, 57 bis 80 und 89 bis 112), die mindestens eine Metall-Kohlenstoff-Doppelbindung enthalten. Die Carbonylkomplexe (kurz Carbonyle) bilden eine große einheitliche Klasse von Komplexen mit CO als Ligand. Carbonylkomplexe gibt es aber von fast allen Metallen. Außer den Neutralmolekülen (z.B. CO) sind auch anionische Komplexe (z.B. OH-), sog. Carbonylate, bekannt. Metallcarbonyle sind häufig Flüssigkeiten, Feststoffe oder von kristalliner Struktur. Im flüssigen Zustand sind sie leicht flüchtig und oft hochgiftig. Die Dämpfe bilden mit Luft explosionsfähige Gemische. Metallcarbonyle sind löslich in vielen organischen Lösungsmitteln wie Benzol, Aceton, Eisessig und Tetrachlorkohlenstoff, jedoch nicht in Wasser.
5Nanotechnologie
Nanotechnologie ist die Veränderung und Generierung von Materialien durch Manipulation der Materie auf atomarer oder molekularer Ebene. Die physikalischen Eigenschaften von Nanopartikeln sind generell durch Quanteneffekt bestimmt. Eine Klasse von Nanopartikeln, welche schon lange bekannt sind und deren Anwendung weitverbreitet ist, sind Metallnanopartikel und im besonderen Goldnanopartikel. Da Gold positivere Potenziale besitzt als alle anderen Metalle, ist es das edelste und damit auch das beständigste aller Metalle. Goldnanopartikel (kolloidales Gold) gehören zu den stabilsten Metallnanopartikeln und zeigen größenabhängige optische und elektronische Eigenschaften, sowie eine sehr komplexe Oberflächenchemie. Gold ist das älteste Metallkoloid, das die Menschheit kennt. Goldkolloide (Goldnanopartikel) werden seit der Antike hergestellt und zur Glasfärbung genutzt. Das älteste Zeugnis dieser frühen Anwendung von kolloidal gelöstem Gold ist der römische Lycurgus Kelch aus dem 4. Jahrhundert nach Christus. Ein antikes Beispiel ist der römische „Lycurgus Kelch“, aus dem 4. Jahrhundert nach Christus. Der reich verzierte gläserne Kelch enthält im Glas dispergierte Goldnanopartikel, absorbiert grünes Licht und erscheint so in Transmission in der Komplementärfarbe Rot. Die ersten systematischen Untersuchungen zur Synthese von kolloidalem Gold datieren aus dem 17. Und 18. Jahrhundert. Die bekanntesten frühen Experimente gehen auf Michael Faraday zurück. Die von ihm vor ca. 150 Jahren hergestellten Goldnanopartikel-Dispersionen sind noch heute stabil und sind in Faradays ursprünglichem Labor im unteren Erdgeschoss der Royal Institution im Faraday Museum ausgestellt und zu besichtigen. Prinzipiell werden Metallnanopartikel in flüssiger Phase meist durch Reduktion eines Metallsalzes oder eines Metallkomplexes mit einem geeigneten Reduktionsmittel hergestellt. Bei dieser Methode werden Kationen der Metalle zu den entsprechenden Atomen reduziert und es bilden sich hochenergetische isolierte Metallatome. Die Stabilität von Nano-Dispersionen hängt von der Wechselwirkungsenergie (attraktive oder repulsive Kräfte)zwischen den Partikeln ab. Als starke attraktive Kräfte wirken Van-der-Waals-Kräfte, während zur Repulsion elektrostatische und/oder sterische Wechselwirkungen beitragen. Als vollständig stabil bezeichnet man Nanopartikel-Dispersionen, wenn weder Koagulation (irreversible Aggregation)) noch Sedimentation (reversible Aggregation) auftreten. Koagulation tritt auf, wenn die attraktiven Wechselwirkungen zwischen den Partikeln die repulsiven Wechselwirkungen überwiegen. Sedimentation von Partikeln tritt auf, wenn die Dichte der Partikel größer ist als die des Dispersionsmediums und die Diffusionsrate kleiner ist als die Sedimentationsrate. Daher neigen große Partikel eher zur Sedimentation, wohingegen kleine Partikel im allgemeinen dispergiert bleiben. Aggregation kann verhindert werden, indem durch den Liganden (Atom oder Molekül, welches über eine koordinative Bindung an ein zentrales Metall-Ion koordiniert.) eine sterische oder elektrostatische Barriere geschaffen wird, welche die großen Kräfte der Van der Waals Anziehung mindestens kompensiert und einen Kontakt der Partikel verhindert. Die sterische Stabilisierung von Nanopartikeln gelingt in polaren und unpolaren (organischen Lösungsmitteln) Medien. Für die konventionelle Darstellung von Goldnanopartikeln wird üblicherweise die Citrat-Methode angewandt. Dabei wird eine wässrige Lösung von Tetrachlorogoldsäure unter Siedehitze mit Natriumcitrat versetzt. Der Fortgang der Reaktion kann an den Farbwechseln, ähnlich wie beim Opus magnum der Alchemisten, abgelesen werden. Die zunächst hellgelbe Goldsalzlösung wird nach Zugabe des Citrats sofort farblos und später innerhalb der ersten Minute grau bis schwarz, um dann blau-violett und später dunkelrot zu werden.